티스토리 뷰
■ 국부 작용
전극의 불순물 때문에 기전력이 감소하는 현상으로 전지를 쓰지 않고 오랜 시간 그냥 두면 못쓰게 되는 현상으로 아연 음극 또는 전해액 중 불순물 (Cu, Ni, Fe, Sb)이 섞이면 국부 전류에 의한 전극의 부분 용해로서 자체방전이 생기고 수명이 단축 됩니다. 이것을 방지하기 위하여 아연 전극에 수은도금을 하거나 순도가 높은 전극 재료를 사용 합니다.
■ 분극 작용(성극 작용)
일정한 전압을 가진 전지에 부하를 걸면 양극 표면에 수소 가스가 생겨서 전류의 흐름을 방행하는 현상으로 전지에 일정한 전류가 흐를 수 있도록 수소를 산화시켜 물로 만드는 감극제를 사용합니다.
위의 현상은 볼타 전지에서 일어나는데 볼타전지는 양극에 구리(Cu), 음극에 아연(Zn)을 사용하고 물에 전기가 흐르도록 묽은 황산(H2SO4)를 넣습니다. 구리판에 생기는 수소를 물로 만들기 위해서 감극제를 사용합니다.
■ 배터리 용어
- 축전지의 용량 : 암페어 아워 AH (Ampere-Hour)
축전지를 일정 전류로 방전시켰을 때 방전시간과 전류량을 곱한 값으로써 축전지의 용량을 나타냅니다.
- 공칭전압 (Nominal Voltage) :
전지전압 표시에 이용되는 표준전압을 말합니다.
- 망간 건전기(1차전지) :
1877년 프랑스 화학자 르클랑셰가 발명한 것으로 당시 기전력 1.5V 정도의 전지 였습니다. 음극인 아연 용기를 사용하며, 이산화망간이 탄소 막대와 더불어 양극을 구성합니다. 전해질로 염화암모늄을 사용합니다. 건전지 중앙의 탄소 막대는 전자를 모아주는 역할을 해서 집전장치라고도 합니다. 이산화망간은 산화제로 수소 발생을 억제하는 감극제 역할을 합니다.
- 알칼리 건전지(1차전지) :
전해질로 수산화칼륨을 쓰기 때문에 알칼리 건전지라 불리고, 산보다 금속을 천천히 부식시키므로 더 오래 사용할 수 있는 장점이 있고 이산화망간과 아연도 다량으로 넣기 때문에 힘도 세다고 합니다.
- 연(납) 축전지는 공칭 전압 1셀당 2.0V, 공칭 용량 10 시간율(Ah)이고,
알칼리 축전지는 공칭 전압 1셀당 1.2V, 공칭 용량 5 시간율(Ah) 입니다.
- 알칼리 축전지 :
전해액으로 수산화칼륨(KOH)를 사용하고 양극은 수산화니켈을 (NiOOH), 음극에 철을 사용한 에디슨축전지와 음극에 카드뮴을 사용한 융너축전지가 있습니다. 악조건에 잘 견디며 자기방전도 적고 수명이 길다는 장점이 있으나 납축전지보다 값이 비싼 단점이 있습니다.
- 기전력 :
전지를 가지고 회로를 구성하는 경우 전지의 내부 저항때문에 흐르는 전류가 증가할 수록 단자의 전압은 낮아지는 전압강하 현상이 발생합니다. 전류가 흐르지 않는 상태의 전압을 전지의 기전력이라하고 E로 표시하고 전지의 내부 저항을 r이라할 때 V = E - Ir 입니다. 전류는 다음과 같이 구할 수 있습니다.
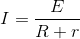
만약 전지를 직렬로 n개 접속 했다면 전류는 다음과 같이 구합니다.

전지를 병렬로 n개 접속 했다면 전류는 다음과 같이 구합니다.
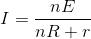
■ 패러데이의 전기분해 법칙
패러데이의 전기분해 법칙은 일반적으로 패러데이 법칙(Faraday's law)이라 하는데 전기분해시 생성물과 이동하는 전하량간의 관계를 법칙화 한 것으로 전기 분해 반응시 생성되거나 소모되는 물질의 양은 이동하는 전하량에 비례하고 전지와 전극의 종류에 무관하다는 법칙입니다. 식으로 표현하면 아래와 같습니다.
W = kQ = kIt[g]
■ 기출문제
※ 이제 기출문제를 통해서 복습해 보겠습니다. "정답보기☞"우측을 클릭하면 답을 확인할 수 있습니다.
1. 전극의 불순물로 인하여 기전력이 감소하는 현상을 무엇이라 하는가?(정답보기☞가)
가. 국부작용 나. 성극작용
다. 전기분해 라. 감극현상
2. 전지의 전압강하 원인으로 틀린 것은?(정답보기☞나)
가. 국부작용 나. 산화작용
다. 성극작용 라. 자기방전
3. 볼타 전지로부터 전류를 얻게 되면 양극의 표면이 수소기체에 의해 둘러싸이게 되는데 이를 무엇이라 하는가?(정답보기☞라)
가. 전해 작용 나. 화학 작용
다. 전기 분해 라. 분극 작용
4. 전지(battery)에 관한 사항이다. 감극제(depolarizer)는 어떤 작용을 막기 위해 사용되는가?(정답보기☞가)
가. 분극작용 나. 방전
다. 순환전류 라. 전기분해
5. 다음은 연축전지에 대한 설명이다. 옳지 않은 것은?(정답보기☞나)
가. 전해액은 황산을 물에 섞어서 비중을 1.2∼1.3 정도로 하여 사용한다.
나. 충전시 양극은 PbO로 되고 음극은 PbSO4로 된다.
다. 방전전압의 한계는 1.8[V]로 하고 있다.
라. 용량은 방전전류 × 방전시간으로 표시하고 있다.
6. 기전력 1.2[V], 용량 20[Ah]인 축전지를 5개 직렬로 연결하여 사용할 때의 기전력은 6[V]로 된다. 이 때 용량[Ah]은?(정답보기☞나)
가. 10 나. 20
다. 40 라. 60
7. 기전력 1.5[V], 내부저항 0.15[Ω]의 전지 10개를 직렬로 접속한 전원에 저항 4.5[Ω]의 전구를 접속하면 전구에 흐르는 전류는 몇[A]가 되겠는가?(정답보기☞나)
가. 0.25 나. 2.5
다. 5 라. 7.5
※ I = E/R+r 공식 적용. 15/(4.5+1.5)
8. 용량 30AH의 전지는 2A의 전류로 몇 시간 사용할 수 있겠는가?(정답보기☞다)
가. 3 나. 7
다. 15 라. 30
※ Ah는 전류 * 시간
9. 전압 1.5V, 내부저항 0.2Ω의 전지 5개를 직렬로 접속하면 전전압은 몇 V인가?(정답보기☞라)
가. 5.7 나. 0.2
다. 1.0 라. 7.5
※ N * 기전력
10. 어떤 전지에 5[A]의 전류가 10분 흘렀다. 이때 도체를 통과한 전기량은 얼마인가?(정답보기☞라)
가. 500[C] 나. 5,000[C]
다. 300[C] 라. 3,000[C]
※ 1Ah = 3,600C, 5 * 1/6 Ah
11. 기전력이 1.5V, 내부저항 0.1Ω인 전지 10개를 직렬로 연결하고 2Ω의 저항을 가진 전구에 연결할 때 전구에 흐르는 전류는 몇 A인가?(정답보기☞라)
가. 2 나. 3
다. 4 라. 5
12. 망간 건전지의 양극으로 무엇을 사용하는가?(정답보기☞다)
가. 아연판 나. 구리판
다. 탄소막대 라. 묽은황산
13. 기전력 4[V], 내부 저항 0.2[Ω]의 전지 10개를 직렬로 접속하고 두극 사이에 부하저항을 접속하였더니 4[A]의 전류가 흘렀다. 이 때 외부저한은 몇 [Ω]이 되겠는가?(정답보기☞다)
가. 6 나. 7
다. 8 라. 9
※ 4 = (4*10)/R+(0.2*10)에서 R을 구합니다.
14. 규격이 같은 축전지 2개를 병렬로 연결하였다. 다음 설명 중 옳은 것은?(정답보기☞라)
가. 용량과 전압이 모두 2배가 된다.
나. 용량과 전압이 모두 1/2배가 된다.
다. 용량은 불변이고 전압은 2배가 된다.
라. 용량은 2배가 되고 전압은 불변이다.
15. 용량이 45[Ah]인 납축전지에서 3[A]의 전류를 연속하여 얻는다면 몇 시간 동안 이 축전지를 이용할 수 있는 가?(정답보기☞나)
가. 10시간 나. 15시간
다. 30시간 라. 45시간
16. 묽은 황산 (H2SO4) 용액에 구리 (Cu)와 아연 (Zn)판을 넣으면 전지가 된다. 이때 양극(+)에 대한 설명으로 옳은 것은?(정답보기☞가)
가. 구리판이며 수소 기체가 발생한다.
나. 구리판이며 산소 기체가 발생한다.
다. 아연판이며 산소 기체가 발생한다.
라. 아연판이며 수소 기체가 발생한다.
17. 기전력 E, 내부저항 r인 전지 n개를 직렬로 연결하여 이것에 외부저항 R을 직렬 연결하였을 때 흐르는 전류I[A]는?(정답보기☞라)

18. 내부 저상이 0.1Ω인 전지 10개를 병렬 연결하면, 전체 내부 저항은?(정답보기☞가)
가. 0.01[Ω] 나. 0.05[Ω]
다. 0.1[Ω] 라. 1[Ω]
19. 납축전지의 전해액는?(정답보기☞나)
가. 염화암모늄 용액 나. 묽은 황산
다. 수산화칼륨 라. 염화나트륨
20. 10[A]의 전류로 6시간 방전할 수 있는 축전지의 용량은?(정답보기☞라)
가. 2[Ah] 나. 15[Ah]
다. 30[Ah] 라. 60[Ah]
21. 기전력 1.5[V], 내부저항 0,2[Ω]인 전지 5개를 직렬로 접속하여 단락시켰을 때의 전류[A]는?(정답보기☞라)
가. 1.5[A] 나. 2.5[A]
다. 6.5[A] 라. 7.5[A]
22. 기전력이 V0 , 내부저항이 r[Ω]인 n개의 전지를 직렬 연결하였다. 전체 내부저항은 얼마인가?(정답보기☞나)
가. r/n 나. nr
다. r/n^2 라. nr^2
23. 다음 중 1차 전지에 해당하는 것은?(정답보기☞가)
가. 망간 건전지 나. 납축 전지
다. 니켈카드뮴 전지 라. 리튬 이온 전지
24. 납축전지의 전해액으로 사용되는 것은?(정답보기☞가)
가. H₂SO₄ 나. H₂O
다. PbO₂ 라. PbSO₄
25. 동일 전압의 전지 3개를 접속하여 각각 다른 전압을 얻고자 한다. 접속방법에 따라 몇 가지의 전압을 얻을 수 있는가? (정답보기☞다)
(단, 극성은 같은 방향으로 설정한다.)
가. 1가지 전압 나. 2가지 전압
다. 3가지 전압 라. 4가지 전압
※ 전체 직렬, 전체 병렬, 직병렬
26. 기전력 1.5V, 내부저항 0.1Ω 인 전지 4개를 직렬로 연결하고 이를 단락했을 때의 단락전류(A)는?(정답보기☞다)
가. 10 나. 12.5
다. 15 라. 17.5
27. 납축전지가 완전히 방전되면 음극과 양극은 무엇으로 변하는가?(정답보기☞가)
가. PbSo4 나. PbSo2
다. H2So4 라. Pb
28. 알칼리 축전지의 대표적인 축전지로 널리 사용되고 있는 2차 전지는?(정답보기☞라)
가. 망간전지 나. 산화온 전지
다. 페이퍼 전지 라. 니켈 카드뮴 전지
29. 내부저항이 2[Ω]인 건전지 10개를 직렬로 연결하고 이것을 다시 병렬로 5개 연결한 전원이 있다. 이 전원의 내부저항은 얼마인가?(정답보기☞라)
가. 1[Ω] 나. 2[Ω]
다. 3[Ω] 라. 4[Ω]
30. 전기분해에 의해서 석출되는 물질의 양은 전해액을 통과한 총 전기량과 같으며, 그 물질의 화학당량에 비례한다. 이것을 무슨 법칙이라 하는가?(정답보기☞라)
가. 줄의 법칙 나. 플레밍의 법칙
다. 키르히호프의 법칙 라. 패러데이의 법칙
31. 패러데이 법칙과 관계가 없는 것은?(정답보기☞라)
가. 전극에서 석출되는 물질의 양은 통과한 전기량에 비례한다.
나. 전해질이나 전극이 어떤 것이라도 같은 전기량이면 항상 같은 화학당량의 물질을 석출한다.
다. 화학당량이란 원자량/원자가 를 말한다.
라. 석출되는 물질의 양은 전류의 세기와 전기량의 곱으로 나타낸다.
32. 페러데이 법칙에서 전기 분해에 의해서 석출되는 물질의 양은 전해액을 통과한 무엇과 비례하는가?(정답보기☞라)
가. 총 전해질 나. 총 전압
다. 총 전류 라. 총 전기량
33. 전기분해를 통하여 석출된 물질의 양은 통과한 전기량 및 화학당량과 어떤 관계인가?(정답보기☞가)
가. 전기량과 화학당량에 비례한다.
나. 전기량과 화학당량에 반비례한다.
다. 전기량에 비례하고 화학당량에 반비례한다.
라. 전기량에 반비례하고 화학당량에 비례한다.
34. 전해액에 전류가 흘러 화학 변화를 일으키는 현상을 무엇이라 하나?(정답보기☞나)
가. 전리 나. 전기분해
다. 화학분해 라. 전기변화
35. 황산구리 용액에 5[A]의 전류로 30[g]의 구리를 석출시키려면 몇 시간 전기분해를 하여야 하는가? (정답보기☞라)
(단, 구리의 전기 화학 당량은 0.0003293[g/C]이다.)
가. 2 나. 3
다. 4 라. 5
※ W = kQ = kIt[g]식을 참조. g/C 값을 기초로 30g에 소요된 총 C를 구하고 5A로 나누고 초를 3600으로 나누어 시간으로 변환.
36. 황산구리가 물에 녹아 양이온과 음이온으로 분리되는 현상을 무엇이라 하는가?(정답보기☞가)
가. 전리 나. 분해
다. 전해 라. 석출
37. 질산은을 전기분해할 때 직류 전류를 10시간 흘렸더니 음극에 120.7[g]의 은이 부착하였다. 이때의 전류는 약 몇 [A]인가?(정답보기☞다)
(단. 은의 전기화학 당량 K=0.001118[g/c)이다.)
가. 1 나. 2
다. 3 라. 4
※ 35번 참조
38. 전기 분해에 의해서 구리를 정제하는 경우, 음극선에서 구리 1kg를 석출하기 위해서는 200A의 전류를 약 몇 시간[h] 흘려야 하는가?(정답보기☞나)
(단, 전기 화학 당량은 0.3293 × 10-3[g/C]임)
가. 2.11[h] 나. 4.22[h]
다. 8.44[h] 라. 12.65[h]
'전기기능사' 카테고리의 다른 글
| 등전위면과 전기장의 세기 - 전기기능사 이론 공부 (0) | 2019.05.03 |
|---|---|
| 전기장의 세기 - 전기기능사 이론 공부 (2) | 2019.04.25 |
| 저항, 전압, 전류의 측정 - 전기기능사 이론 공부 (1) | 2019.04.12 |
| 열전기 현상 - 전기기능사 이론 공부 (0) | 2019.04.09 |
| 전류의 발열 작용 - 전기기능사 이론 공부 (0) | 2019.04.08 |
